Тема: Хімічні властивості та практичне використання середніх солей.
Мета: узагальнити та систематизувати знання учнів про класифікацію, номенклатуру, фізичні властивості солей; дати уявлення про основні хімічні властивості солей;оксидів, кислот, основ, солей; формувати лабораторні вміння; розвивати навички роботи в групі; формувати творче мислення.
Тип уроку: урок вивчення нового матеріалу.
Методи та прийоми: робота в групах, «Дерево пізнань», гра «Хрестики-нулики», гра «Третій – зайвий», міні-проект, лабораторні досліди, демонстраційний експеримент, демонстрування презентації, графічний диктант, складання сенкану.
Обладнання: Віртуальна хімічна лабораторія, мідний дріт, спиртівка, залізний цвях, розчини HCl та NaOH, CuSO4, Na2CO3, AgNO3, штатив, пробірки, презентація "Солі"
Хід уроку:
І. Організаційний момент. Привітання, представлення.
Пропозиція вибрати колір бейджика згідно настрою та розподілитися таким чином на групи; “Жовті”, “Зелені”, “Червоні”; вибір координаторів груп.
ІІ. Актуалізація опорних знань.
- Бліц-опитування:
- Які класи складних неорганічних сполук вам відомі?
- Дайте визначення оксидів.
- Як класифікують оксиди?
- Який оксид є найпоширенішим у природі?
- Дайте визначення кислот..
- Як класифікують кислоти?
- Які сполуки називають основами?
- Як класифікують основи?
- Що таке луги?
2. Гра «хрестики-нулики».
4. Оформлення «Дерева пізнань» Напишіть, що ви знаєте про солі?
- Початок роботи над міні-проектом “Солі”.
ІІІ. Основна частина. Вивчення нового матеріалу.
1. ММШ. Які хімічні властивості, на вашу думку будуть характерні для солей? Запис ідей. Давайте перевіримо наші гіпотези на практиці.
- Віртуальний експеримент. Зразки солей.
- Виконання лабораторних дослідів №7, 8, 9; консультації координаторів груп.
- Демонстраційний дослід. Взаємодія нітрату срібла з міддю.
- Аналіз гіпотез стосовно хімічних властивостей солей. Формулювання висновків.
- Практичне застосування солей. Бесіда з демонструванням презентації.
- Захист міні-проектів.
IV. Закріплення.
- Вправи на виявлення хімічних властивостей солей.
- Написання рівнянь відповідних хімічних реакцій.
- Розв’язування задачі. Яку масу крейди необхідно взяти для добування 2,24л вуглекислого газу?
V. Підсумок уроку
1.Графічний диктант.
- NaOH – це сіль
- NaCl – це сіль
- Мідь може витісняти ФЕРУМ з його солей
- Na2SO4 – натрій сульфід
- Залізо може витісняти Купрум з його солей
- Солі завжди взаємодіють з лугами
- Na2SO4 – натрій сульфат
- CaCO3 – крейда застосовується в харчовій промисловості
- NaCl - застосовується в харчовій промисловості
- Солі взаємодіють з лугами, якщо утворюється осад
- Солі взаємодіють з оксидами
- Солі нітратної кислоти застосовуються як добрива
- Дооформлення «Дерева пізнань» Що нового ви дізналися про солі?
3. Створення сенкану:
Солі
Метал і кислотний залишок
Хімічно активні
Широко застосовуються
Складні речовини
VІ. Оцінювання вчителем роботи координаторів груп. Оцінювання координаторами роботи груп. Мотивація
VІІ. Домашнє завдання: параграф 14 – вивчити, лабораторні досліди 7.8,9 описати в робочому зошиті.
Додаткові матеріали до уроку:
1. Виберіть метали,які витісняють атоми Гідрогену з кислот
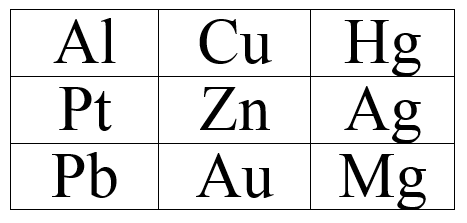
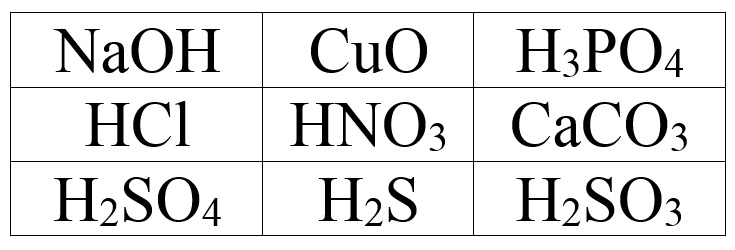
2.Виберіть оксигеновмісні кислоти
3. Виберіть ті речовини, які взаємодіють з (HCl)
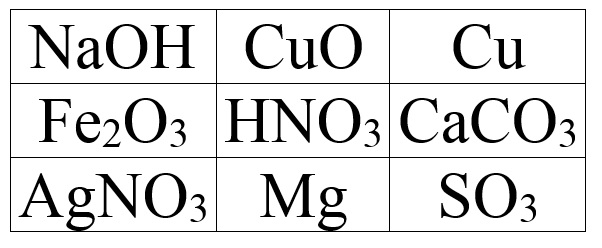
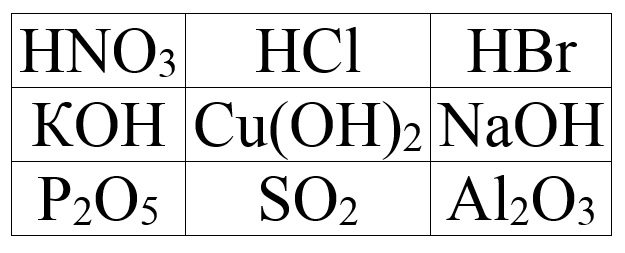
4.«Третій – зайвий»
5. З’єднайте стрілочками із центральною речовиною тільки ті речовини, що можуть із нею взаємодіяти
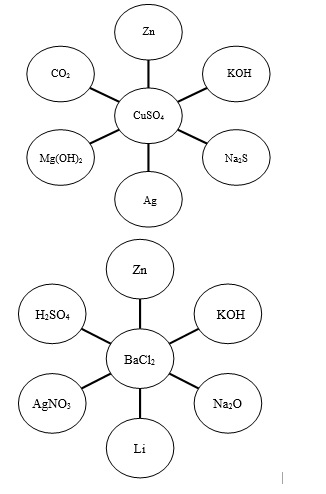
6. Правила техніки безпеки на уроці хімії переглянути
7. Лабораторні досліди з теми завантажити







