Тема. Масова частка елементів у речовині.
Мета: закріпити знання про хімічні формули й уміння обчислювати відносну молекулярну масу; розширити знання про частки з математики для обчислення масової частки елемента в складі речовини; навчити обчислювати масову частку елемента в складі складних речовин, використовувати поняття «масова частка» для розв’язання задач на визначення хімічних формул.
Тип уроку: поглиблення знань, формування практичних умінь і навичок.
Методи та прийоми: фронтальне опитування, самостійна робота, евристична бесіда.
Обладнання: періодична система хімічних елементів, презентація "Масова частка".
ХІД УРОКУ:
II. Фронтальне опитування, перевірка домашнього завдання
• На які два класи поділяються речовини за складом?
• Які речовини називаються простими?
• Які речовини називаються складними?
• Що таке хімічна формула?
• Що виражає хімічна формула?
• Що таке відносна атомна маса?
• Що таке відносна молекулярна маса?
• Як, знаючи формулу речовини, обчислити відносну молекулярну масу? Перевірка домашнього завдання:
Mr (PbО)= 223; Mr(BaSО4)= 233; Mr(KCl) = 74,5; Mr(AgNО3) = 170.
III. Актуалізація опорних знань
• чи можна стверджувати, що маси кожного атома в молекулі речовини однакові? (Ні, тому що в усіх елементів різні атомні маси)
• Співвідношення мас атомів у складі молекули складної речовини постійне чи змінне? (Постійне, тому що постійним є склад речовини)
• Як обчислити співвідношення мас атомів у молекулі?
Розгляньмо на прикладі бінарних сполук
CaO
Ar(Ca) = 40; Ar(О) = 16;
m(Ca): m(O) = 40:16 = 10:4 = 5:2.
Отже, співвідношення мас атомів можна виразити невеликими додатними цілими числами
Ag2О
Ar(Ag) = 108; Ar(О) = 16;
m(Ag): m(O) = 216:16 = 108:8 = 27:2.
Це співвідношення постійне. Обчислимо співвідношення атомів у молекулі
KNO3.
Ar(K) = 39; Ar(N) = 14; Ar(O) = 16;
m(K): m(N): m(O) = 39:14:48.
• Як можна виразити склад речовини у відсотках? (Якщо прийняти відносну молекулярну масу речовини за 100 %, то маса кожного елемента може бути виражена як масова частка цього елемента в складі молекули)
Наприклад:
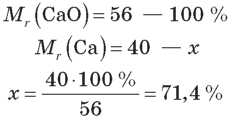
Виражена у відсотках, ця величина є масовою часткою елемента в складі речовини(ω).
IV. Формування практичних умінь і навичок
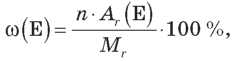
де n — число атомів елемента в молекулі; Аr — відносна атомна маса елемента; Mr — відносна молекулярна маса.
Наприклад: Na2O.
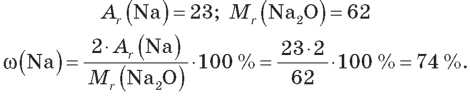
Тоді
ω(O) = 100 % -ω(Na) = 100 % - 74 % = 26 %.
Розв’яжемо наступні задачі. (Біля дошки працює учень.)
Завдання 1. Обчисліть масові частки елементів у молекулі вуглекислого газу CO2.
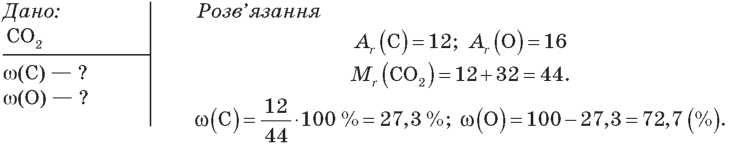
Відповідь: ω(C) = 27,3 %; ω(О) = 72,7 %.
Завдання 2. Самостійна робота з навчальною таблицею 1 до уроку 10 з перевіркою і коригуванням результатів/
— Обчисліть масові частки елементів у складних речовинах з ряду 12 у навчальній таблиці
ZnS, Ca3P2, Al4C3, CH4, Fe2O3.
Після закінчення роботи на дошці виписуємо всі отримані учнями результати, визначаємося з помилками й коригуємо
Mr(ZnS) = 97 Mr(Ca3P2) = 182
ω(Zn) = 67 % ω(Са) = 66 %
ω(S) = 33 % ω(Р) = 34 %
Mr(Al4C3 ) = 144 Mr(CH4 ) = 16
ω(Al) = 75 % ω(С) = 75 %
ω(С) = 25 % ω(Н) = 25 %
Mr(Fe2O3) = 160
ω(Fe) = 70 %
ω(О) = 30 %
V. Узагальнення і підбиття підсумків
Оцінюємо роботу учнів, виставляємо оцінки.
VI. Домашнє завдання
Прочитати параграф, відповісти на запитання. Обчислити масові співвідношення елементів і масові частки елементів у молекулах:
MgCl2, NaBr, PH3, CrО3 .







