Тема. Валентність хімічних елементів.
Мета: визначити поняття «валентність»; ознайомити учнів зі значеннями валентностей окремих атомів; показати учням найпростіші способи визначення валентності; навчити визначати валентність.
Тип уроку: вивчення нового матеріалу.
Методи та прийоми: розповідь, тренувальні вправи.
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, презентація "Валентність".
ХІД УРОКУ
II. Мотивація навчальної діяльності та засвоєння нових знань
1) Що таке хімічна формула?
2) Що таке молекула?
3) Яку інформацію можна одержати про молекулу з хімічної формули?
4) Як скласти формулу хімічної сполуки?
(Потрібно знати, з атомів яких хімічних елементів складається молекула цієї речовини. Необхідно знати кількість атомів кожної речовини.)
5) Чому атоми хімічних елементів утворюють молекули в точно визначеному співвідношенні?
(Атоми мають властивість, що визначає здатність атома певного хімічного елемента приєднувати визначене число атомів інших елементів).
Ми будемо називати цю здатність валентністю.
За одиницю валентності приймають валентність атома Гідрогену. Вона дорівнює І.
Вважають, що Гідроген у сполуках одновалентний. За кількістю атомів Гідрогену, яку може приєднати атом, можна визначити його валентність.
Наприклад, HCl: у Хлору в цій сполуці валентність І, тому що він приєднує один атом Гідрогену.
За правилом: сума одиниць валентностей атомів одного елемента дорівнює сумі одиниць валентностей іншого елемента.
H2S — у Сульфуру в цій сполуці валентність ІІ;
PH3 — у Фосфору валентність ІІІ;
CH4 — у Карбону валентність IV.
III. Формування і закріплення вмінь
Тренувальні вправи на визначення валентностей за формулами бінарних сполук.
Слід відзначити, що багато атомів не мають постійної валентності, так атом Купруму в сполуках може виявляти валентності І і IІ: Атом Оксигену О має в більшості своїх сполук з іншими елементами валентність ІІ.
CuO і Cu2O
— У чому причина відмінності цих двох формул? (У валентності атома Купруму)
Для визначення валентності елементів можна використати періодичну систему. Для цього скористаймося такими рекомендаціями:
• для атомів елементів І, ІІ, ІІІ груп головної підгрупи валентність завжди дорівнює номеру групи;
• для атомів елементів IV, V, VI, VII груп головної підгрупи найбільша валентність у сполуках з Оксигеном дорівнює номеру групи;
• для атомів елементів IV, V, VI, VII груп головної підгрупи валентність у сполуках з Гідрогеном дорівнює 8 мінус номер групи;
• для атомів елементів зі змінною валентністю валентність указується в дужках поряд з назвою або хімічним символом елемента;
• валентність можна розрахувати за валентністю атома з відомою валентністю в бінарних сполуках разом із класом виконуємо завдання.
1) Розрахуйте валентність атомів у сполуках за валентністю атома Гідрогену.
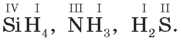
2) розрахуйте валентність атомів у сполуках з Оксигеном.
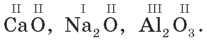
3) Робота в парах.
Пари одержують картку з номером валентності.
— Виберіть з переліку сполуки Оксигену з атомами хімічних елементів з валентністю:
пара 1 — II; пара 2 — III; пара 3 — IV; пара 4 — V;
пара 5 — I; пара 6 — VI; пара 7 — VII.
Список сполук у всіх однаковий:
Cr2О3, K2О, FeO, Fe2О3, As2О5, Cl2О7, CrО3, Li2О,
HgO, SiО2, P2О5, SО3, PbО2, Mn2О7.
Представник пари, яка швидше за інших виконала завдання, виписує формули своєї групи на дошці під відповідним номером валентності:
|
I |
II |
III |
IV |
V |
VI |
VII |
|
Li2О |
FeO |
Cr2О |
SiО2 |
AS2О5 |
SO3 |
Cl2О7 |
|
K2О |
HgO |
Fe2О3 |
PbО2 |
P2О5 |
CrО3 |
Mn2О7 |
Разом із класом коригуємо відповіді на дошці й підбиваємо підсумки уроку.
IV. Домашнє завдання
Прочитати параграф, відповісти на запитання . Визначити валентність атомів у сполуках:
SnО2, BeO, AsH3, MnО2, H2Se, Cl2О.







